Pengertian Gas Mulia
Gas mulia ini merupakan unsur-unsur yang berada di golongan VIIIA. Hal tersebut sebagaimana selain berfase gas disuhu ruang, unsur ini memiliki sifatnya yang sangat stabil (sukar bereaksi). Pada mulanya , unsur-unsur tersebut kemudian dikenal dengan sebutan gas inert disebabkan oleh karna tidak ada satupun unsur yang kemudian bereaksi dengan unsur lain dalam membentuk senyawa. Barulah di tahun 1962, Neil Bartlett, yang merupakan seorang ahli kimia asal Kanada, kemudian berhasil mensintesis senyawa xenon XePtF6. Sejak saat itu, segala macam senyawa gas mulia kemudian berhasil disintesis. Unsur-unsur gas mulia tersebut terdiri dari kripton (Kr), helium (He), xenon (Xe), argon (Ar), neon (Ne) serta juga radon (Rn).
Keberadaan Gas Mulia di Alam
Oleh sebab karna memiliki sifat yang stabil, di alam gas mulia itu kemudian ditemukan di dalam bentuk monoatomik (atom tunggal). Unsur gas mulia tersebut, kecuali radon, dapat atau bisa ditemukan di udara diatmosfer meskipun di dalam situasi atau kondisi konsentrasi yang sangat kecil. Di antara gas mulia, argon ini adalah yang paling dominan atau banyak terdapat di udara yakni dengan kadar itu adalah 0,93% di dalam udara kering (yakni bebas uap air). Helium itu lebih banyak ditemukan didalam gas alam (yakni dengan kadar ialah ~1%) dibandingkan dalam udara (yakni ~0,00052%). Sementara itu radon ini berasal dari peluruhan radioaktif radium serta juga uranium. Radon tersebut juga memiliki atau mempunyai sifatnya radioaktif serta juga mempunyai waktu paro yang juga relatif pendek sehingga kemudian membuat radon tersebut akan kembali meluruh serta juga menjadi unsur lainnya.
Sifat Gas Mulia
Terdapat beberapa sifat gas mulia, diantaranya sebagai berikut :
Sifat atomik
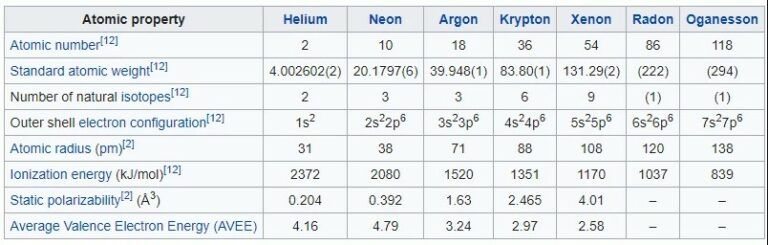
Unsur gas mulia itu memiliki atau juga mempunyai konfigurasi elektron valensi yang oktet, yakni dengan ns2 np6, kecuali di He tersebut dengan konfigurasi duplet 1s2. Jari-jari atom yang dari He ke Rn itu kemudian bertambah sebagaimana bertambahnya juga jumlah kulit elektron. Konfigurasi elektron tersebut yakni dengan kulit valensi terisi penuh demikian kemudian menyebabkan atau membuat dampak gas mulia tersebut jadi cenderung sangat stabil (yakni sangat sukar bereaksi).
Selain dari itu, unsur gas mulia tersebut mempunyai atau juga memiliki energi ionisasi yangcukup besar serta juga afinitas elektron yangsangat rendah. Energi ionisasi dari He ke Rn tersebut kemudian semakin berkurang, sebagaimana bertambahnya jari-jari atom sehingga kemudian gaya tarik inti terhadap elektron valensi tersebut juga semakin melemah serta energi yang diperlukan atau dibutuhkan untuk melepaskan elektron itu semakin berkurang.
Sifat fisis
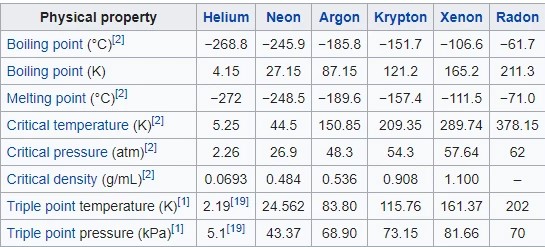
Unsur-unsur gas mulia ini mempunyai titik leleh serta titik didih yang sangat rendah. Titik didihnya ini hanya beberapa derajat Celcius di atas titik lelehnya. Titik leleh serta juga juga titik didih dari He itu ke Rn itu bertambah sebagaimana dengan kekuatan gaya London (yakni gaya dispersi) yang bertambah seiring yakni dengan bertambahnya massa atom serta juga jari-jari atom.
Densitas (kerapatan) gas mulia ini juga cenderung bertambah dari He ke Rn. Densitas gas ini kemudian dipengaruhi oleh massa atom, jari-jari atom, serta juga gaya London. Densitas gas ini kemudian akan bertambah beriringan dengan bertambahnya massa atom danjuga kekuatan gaya London, namun kemudian akan berkurang yakni dengan bertambahnya jari-jari atom. Namun demikian, pengaruh massa atom serta juga gaya London lebih signifikan dibanding pengaruh jari-jari atom di dalam hal ini, sehingga densitas bertambah dari He ke Rn.
Sifat kimia
Oleh karena disebabkan konfigurasi elektron yang stabil, unsur gas mulia itu kemudian juga cenderung tidak reaktif (artinya ialah sangat sulit bereaksi). Hal tersebut kemudian dibantu juga oleh fakta bahwa di alam gas mulia yang selalu ditemukan didalam suatu bentuk monoatomik (yakni atom tunggal). Namun demikian, para ahli telah atau sudah berhasil mensintesis senyawa gas mulia Kr, Ar, Xe, serta juga Rn. Kereaktifan unsur tersebut meningkat dari Ar ke Rn, yangmana di dalam reaksi dengan fluorin, Rn itu bisa atau dapat bereaksi spontan, Xe itu kemudian memerlukan pemanasan atau juga penyinaran dengan sinar UV supaya reaksi berlangsung, serta Kr hanya bereaksi apabila diberi muatan listrik atau juga sinar X disuhu yang sangat rendah.
Unsur He serta Ne ditemukan tidak mengalami reaksi kimia serta juga membentuk senyawa. Unsur Ar ini kemudian diketahui bereaksi dengan HF membentuk senyawa HArF di suhu 18 K. Unsur Kr bisa atau dapat bereaksi dengan F2 membentuk senyawa KrF2 di dalam kondisi didinginkan pada −196°C serta juga diberi loncatan muatan listrik atau pun juga radiasi sinar X. Unsur Xe bisa atau dapat bereaksi yakni dengan F2 membentuk tiga senyawa fluorida biner yang berbeda—XeF2, XeF4, serta juga XeF6—bergantung pada kondisi reaksi serta jumlah reaktan. Unsur Rn bereaksi dengan secara spontan yakni dengan F2 membentuk senyawa RnF2.
Tabel Sifat Fisis dan Kimia
| Unsur | KonfigurasiElektron Valensi | Jari-Jari Atom(Å) | Energi Ionisasi(kJ/mol) | Titik Didih(⁰C) | Titik Leleh(⁰C) |
| 2He | 1s2 | 0,50 | 2379 | -268,9 | -272,2 |
| 10Ne | 2s2 2p6 | 0,65 | 2087 | -248,0 | -248,6 |
| 18Ar | 3s2 3p6 | 0,95 | 1527 | -185,9 | -189,4 |
| 36Kr | 4s2 4p6 | 1,10 | 1357 | -153,4 | -157,2 |
| 54Xe | 5s2 5p6 | 1,30 | 1177 | -108,1 | -111,8 |
| 86Rn | 6s2 6p6 | 1,45 | 1043 | -62 | -71 |
Manfaat Gas Mulia dalam Kehidupan Sehari-hari
Dibawah ini merupakan kegunaan atau manfaat dari Gas Mulia dalam kehidupan sehari-hari, diantaranya sebagai berikut :
Helium
- Helium ini dipakai yakni sebagai gas pengisi balon udara yakni menggantikan gas hidrogen disebabkan oleh karna selain ringan juga memiliki sifat inert.
- Helium cair dipakai atau digunakan untuk pendingin koil logam dialat scanner tubuh (MRI) serta juga pendingin di dalam penelitian cryogenics danjuga superkonduktor yakni sebagaimana titik didihnya yang sangat rendah.
- Helium ini kemudian dipakai atau digunakan yakni sebagai pelarut gas oksigen di dalam tabung oksigen penyelam ataupun juga tabung oksigen rumah sakit. Helium ini kemudian dipilih yakni menggantikan nitrogen disebabkan karna selain mempunyai atau memiliki sifat inert, kelarutan pada gas helium di dalam darah tersebut juga lebih kecil pabila dibanding dengan adanya gas nitrogen.
Neon
Neon ini kemudian dipakai atau digunakan untuk lampu reklame. Hal tersebut sebagaimana pada gas neon di dalam tabung bertekanan rendah tersebut kemudian akan menghasilkan cahaya merah yakni dengan intensitas tinggi apabila diberi suatu tegangan listrik.
Argon
- Argon dipakai atau digunakan yakni sebagai gas pengisi di dalam beberapa jenis bola lampu yang disebabkan karna memiliki sifat yang tidak reaktif sehingga kemudian filamen wolfram tersebut tidak mudah putus.
- Argon ini kemudian digunakan atau dipakai yakni sebagai atmosfer inert pada pengelasan; sintesis kristal tunggal silikon atau pun juga germanium di dalam industri semikonduktor; serta juga eksperimen dalam glove box di laboratorium.
Kripton
Kripton ini bisa atau dapat menghasilkan cahaya putih yakni dengan intensitas tinggi apabila diberi muatan listrik sehingga banyak digunakan atau dipakai pada lampu landasan pesawat serta juga lampu fotografi berkecepatan tinggi.
Xenon
- Xenon ini juga digunakan atau dipakai untuk lampu blitz fotografi dan juga untuk beberapa jenis lampu mobil disebabkan oleh karna bisa atau dapat menghasilkan suatu cahaya putih yang begitu terang yakni dengan adanya muatan listrik.
- Xenon dapat digunakan atau dipakai yakni sebagai obat bius (anestetik). Namun, penggunaannya ini sangat terbatas sehubungan yakni dengan harganya yang sangat mahal.
Radon
Radon digunakan atau dipakai di dalam radioterapi kanker (terapi radiasi) sebagaimana sifatnya itu yang radioaktif.
Radon ini kemudian bisa atau dapat menjadi indikator keberadaan mineral radioaktif seperti misalnya bijih uranium di dalam tanah, bebatuan, ataupun juga bahan bangunan.
Fungsi Gas Mulia
Dibawah ini merupakan fungsi dari gas mulia, diantaranya sebagai berikut :
Argon
Di dalam proses metalurgi, argon tersebut banyak digunakan atau dipakai untuk memberikan keadaan atmosfer inert yang dibutuhkan atau diperlukan. Suasana inert ini kemudian akan memberikan peran penting di dalam stainless steel, pengelasan titanium, aluminium, serta juga magnesium. Serta juga digunakan atau dipakai di dalam produksi titanium. Argon di dalam jumlah terbatas digunakan atau dipakai dalam kristal germanium serta silikon yang digunakan atau dipakai di dalam bola lampu listrik, transistor, dll.
Helium
Helium digunakan atau dipakai di dalam reaktor nuklir yakni sebagai gas pendingin serta dipakai yakni sebagai gas aliran di dalam kromatografi gas cair. Ia kemudian menemukan penerapannya di kapal udara serta juga balon helium. Titik didih helium ini merupakan yang paling sedikit apabila dibandingkan yakni dengan cairan lainnya. Ini digunakan atau dipakai untuk mendapatkan suhu terendah yang kemudian dibutuhkan dalam laser.
Balon helium ini dipakai atau digunakan untuk memeriksa cuaca di wilayah tertentu. Helium lebih disukai daripada hidrogen walaupun hidrogen lebih murah, disebabkan karna ahidrogen ini sangat mudah terbakar serta juga sangat riskan bagi resiko keamanan.
Helium juga digunakan atau dipakai oleh penyelam untuk mencairkan oksigen lebih baik dari nitrogen di dalam tabung gas yang dipakai oleh mereka disebabkan karna nitrogen tersebut bisa atau dapat dengan mudah larut di dalam darah yang menghasilkan kondisi atau situasi menyakitkan yang disebut dengan bends. Risiko helium ini kemudian menyebabkan bends sedikit lebih rendah dari nitrogen.
Neon
Neon digunakan atau dipakai di dalam tabung pelepasan yang memiliki fungsi mengahasilkan warna oranye kemerahan yang dihasilkan oleh lampu neon.
Xenon Dan Krypton
Xenon serta krypton ini kemudian menemukan aplikasi mereka di dalam unit flash fotografi disebabkan karna bisa atau dapat mengahasilkan generasi cahaya yang sangat cerah. Itu juga dipakai atau digunakan di mercusuar.
Oganesson
Disebabkan karna hanya beberapa atom oganesson yang pernah dibuat, ia kemudian tidak memiliki kegunaan praktis di luar studi ilmiah.
Kelimpahan Gas Mulia
Kelimpahan gas mulia ini semakin berkurang seiring dengan meningkatnya jumlah atom. Helium tersebut adalah unsur yang paling banyak ditemukan di alam semesta setelah adanya hidrogen.
Semua gas mulia yang terdapat diatmosfer bumi kecuali untuk radon serta juga helium, sumber utama untuk mereka itu ialah udara, serta juga dari udara tersebut radon bersama dengan helium itu dihasilkan yakni dengan cara pencairan serta juga distilasi fraksional.
Helium pada umumnya diciptakan dengan secara komersial pada sumur gas alam tertentu. Radon ini biasanya diisolasi yakni sebagai hasil dari dekomposisi radioaktif dari senyawa radium. Inti atom radium akan secara spontan menghilang disebabkan karna adanya emisi dari energi serta partikel.
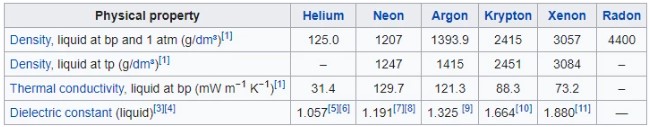
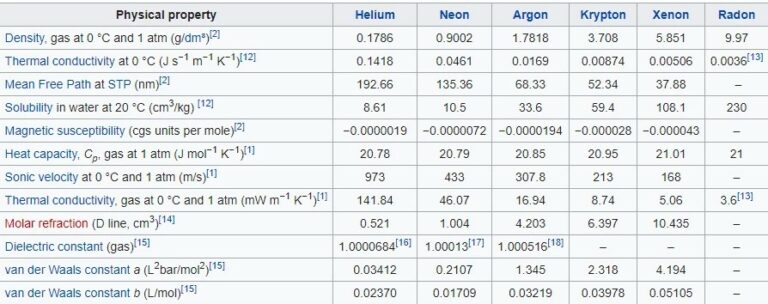
Table Sifat Fisik Gas Mulia
Dibawah ini merupakan tabel sifat fisik gas mulia, mulai dari dalam bentuk padatam, cairan, gas, perubahan fase dan sifat kritis, sifat atom gas mulia, sebagai berikut :
Dalam Bentuk Padatan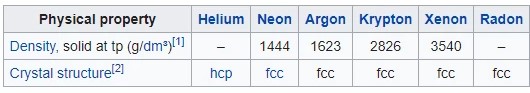
Dalam bentuk cairan
Dalam bentuk gas
Perubahan Fase dan Sifat Kritis
Sifat Atom Gas Mulia
Contoh Gas Mulia
Berdasarkan penjelasan diatas, dibawah ini merupakan contoh dari Gas Mulia, diantaranya sebagai berikut :
- Gas helium
- Neon
- Argon
- Kripton
- Xenon
Demikianlah penjelasan mengenai Pengertian Gas Mulia, Fungsi, Tabel, Manfaat, Sifat dan Contoh, semoga apa yang diuraikan dapat bermanfaat untuk anda. Terima kasih
[irp]
[irp]
[irp]