Pengertian Reaksi Kimia
Reaksi kimia ini merupakan suatu proses di mana suatu zat mengalami perubahan kimia untuk kemudian membentuk zat baru. Pada reaksi kimia, terjadi suatu interaksi dari dua atau juga bahkan lebih bahan kimia yang menghasilkan satu atau pun lebih senyawa kimia baru atau pun juga mengubah sifat bahan kimia campuran. Kebanyakan daru reaksi kimia itu memerlukan tekanan, radiasi, panas, kondisi khusus serta juga atau katalis (zat untuk bisa mempercepat proses reaksi).
Dari definisi reaksi kimia di atas, kemudian ketahui bahwa reaksi kimia tersebut bisa atau dapat mengubah sifat bahan kimia. Lalu pada fenomena batang korek api yang kemudian dibakar di atas, sifat apakah yang kemudian berubah? Sifat yang kemudian berubah dari batang korek api yang dibakar itu adalah dari warna. Dalam hal ini terjadi suatu perubahan warna pada batang korek api dari yang dari awalnya bewarna putih kekuningan kemudian menjadi hitam pekat.
Jenis Reaksi Kimia dan Contohnya
Reaksi Searah atau Reaksi Tidak Dapat Balik (lrreversibel)
- persamaan reaksi ditulis dengan satu anak panah ke arah produk/kanan (→)
- reaksi akan berhenti setelah salah satu atau semua reaktan habis;
- produk tidak dapat terurai menjadi zat-zat reaktan;
- reaksi berlangsung tuntas/berkesudahan.
NaOH(aq)+ HCI(aq) →NaCI (aq) + H2O(ℓ)
Reaksi Dua Arah atau Reaksi Dapat Balik (Reversibel)
- persamaan reaksi ditulis dengan dua anak panah dengan arah berlawanan (⇔);
- reaksi ke arah produk disebut reaksi maju, reaksi ke arah reaktan disebut reaksi balik.
Reaksi kimia ini kemudian cenderung melibatkan adanya gerakan elektron yang mengarah pada suatu pembentukan serta juga memecah ikatan kimia. Dalam ilmu kimia, jenis-jenis reaksi kimia ini juga sangat beragam. Oleh sebab itu, untuk memudahkan di dalam mempelajarinya, kita dapat atau bisa mengelompokkan jenis reaksi kimia dengan berdasarkan bagaimana cara atom tersebut tersusun kembali pada hasil reaksi. Dibawah ini merupakan beberapa jenis reaksi kimia dengan penjelasan serta juga contohnya.
-
Reaksi Pembakaran
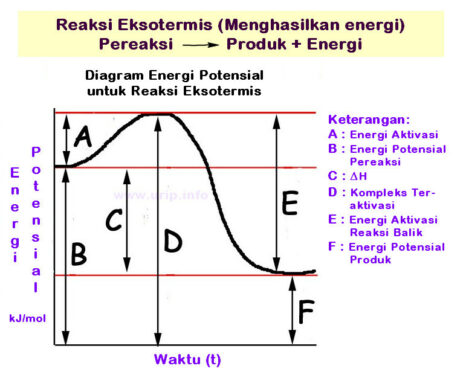
Reaksi pembakaran tersebut adalah suatu reaksi antara suatu zat yakni dengan oksigen kemudian menghasilkan zat yang jenisnya baru. Reaksi pembakaran ini merupakan jenis reaksi redoks yangmana bahan yang mudah terbakar tersebut kemudian bergabung dengan oksidator untuk dapat membentuk produk teroksidasi serta juga menghasilkan panas (reaksi eksotermis).
Biasanya di dalam oksigen, reaksi pembakaran tersebut bergabung dengan senyawa lain untuk kemudian membentuk karbon dioksida serta juga air. Contoh dari reaksi pembakaran ini merupakan pembakaran naftalena menghasilkan gas karbon dioksida serta juga uap air dengan persamaan reaksi sebagai berikut.
C10H8 + 12O2 → 10CO2 + 4H2O
-
Reaksi Penggabungan
Di dalam reaksi penggabungan (kombinasi) atau pun juga reaksi sintesis, dua atau bahkan lebih senyawa kimia sederhana kemudianbergabung untuk dapat membentuk produk yang lebih kompleks. Secara matematis, persamaan reaksi sintesis tersebut kemudian dituliskan di dalam bentuk berikut.
A + B → AB
Contoh dari reaksi ini merupakan suatu reaksi kombinasi antara besi serta juga belerang di dalammembentuk besi(II) sulfida yakni dengan persamaan reaksi sebagai berikut.
8Fe + S8 → 8FeS
-
Reaksi Penguraian
Di dalam Reaksi penguraian (dekomposisi) atau pun juga reaksi analisis yang terjadi merupakan kebalikan dari adanya reaksi penggabungan yangmana suatu zat terurai atau pun juga terpecah menjadi dua atau bahkan lebih senyawa baru yang lebih kecil. Secara matematis, bentuk dari persamaan reaksi analisis ini ialah sebagai berikut.
AB → A + B
Contoh dari reaksi dekomposisi adalah peristiwa elektrolisis senyawa air itu menjadi oksigen serta juga gas hidrogen itu dengan persamaan reaksi dibawah ini :
2H2O → 2H2 + O2
-
Reaksi Penggantian Tunggal
Reaksi pergantian (subtitusi) tunggal atau pun juga reaksi pertukaran tunggal tersebut terjadi apabila sebuah unsur itu menggantikan kedudukan unsur lain di dalam suatu reaksi kimia. Reaksi penggantian tunggal tersebut kemudian sering disebut juga dengan istilah reaksi pendesakan. Bentuk dari persamaan reaksi pemindahan tunggal secara matematis ialah dibawah ini :
A + BC → AC + B
Contoh dari reaksi pertukaran tunggal ini ialah reaksi pada saat seng bergabung dengan adanya asam klorida. Pada reaksi tersebut, kedudukan unsur seng tersebut menggantikan kedudukan hidrogen diproduk (hasil reaksi). Persamaan dari reaksinya ini ialah sebagai berikut.
Zn + 2HCl → ZnCl2 + H2
-
Reaksi Penggantian Rangkap
Di dalam reaksi penggantian rangkap disebut juga dengan sebutan reaksi metatesis, 2 senyawa obligasi atau pun juga ion itu kemudian ditukar untuk dapat membentuk suatu senyawa yang berbeda. Supaya kalian dapat lebih paham, perhatikan bentuk dari persamaan reaksi metatesis dibawah ini.
AB + CD → AD + CB
Contoh dari reaksi penggantian rangkap atau pun juga penggantian ganda ini terjadi antara natrium klorida serta juga perak nitrat yang membentuk natrium nitrat serta perak klorida. Persamaan dari reaksinya ialah sebagai berikut.
NaCl + AgNO3 → NaNO3 + AgCl
-
Reaksi Redoks (Reduksi-Oksidasi)
Reaksi redoks ini merupakan suatu reaksi yangmana bilang oksidasi (biloks) dari atom-atom yang bereaksi itu mengalami perubahan. Apabila terjadi pengurangan bilangan oksidasi itu disebut dengan reduksi serta jika terjadi penambahan disebut dengan oksidasi. Perubahan bilangan oksidasi ini kemudian terjadi sebab pada reaksi redoks itu melibatkan transfer elektron antara senyawa kimia.
Contoh dari reaksi redoks ini ialah reaksi yang terjadi pada saat I2 direduksi tersebut menjadi I- serta S2O32- (anion tiosulfat) dioksidasi itu menjadi S4O62-. Persamaan dari reaksinya ialah sebagai berikut.
2S2O32- + I2 → S4O62- + 2I–
-
Reaksi Pengendapan
Reaksi pengendapan ini merupakan suatu proses reaksi yang kemudian membentuk endapan, seperti pada reaksi antara timbal(II) nitrat serta juga kalium iodida yang kemudian menghasilkan endapan bewarna kuning yakni timbal(II) iodida serta juga larutan kalium nitrat. Persamaan dari reaksi kimianya ialah sebagai berikut.
Pb(NO3)2 + 2KI → PbI2 + 2KNO3
-
Reaksi Netralisasi
Reaksi netralisasi disebut juga dengan reaksi asam-basa ini merupakan jenis reaksi penggantian rangkap yang terjadi antara asam serta juga basa. Ion H+ di dalam asam bereaksi dengan ion OH- dalam basa untuk kemudian membentuk senyawa air serta juga garam ionik. Secara matematis, bentuk persamaan reaksi netralisasi ini ialah sebagai berikut.
HA + H2O → BOH + BA
Contoh dari reaksi netralisasi ini ialah reaksi antara asam bromida serta juga natrium hidroksida yang membentuk garam natrium bromida serta juga air. Persamaan dari reaksinya ialah sebagai berikut.
HBr + NaOH → NaBr + H2O
-
Reaksi Pembentukan Gas
Reaksi pembentukan gas ini merupakan reaksi kimia yang pada produknya itu dihasilkan gas. Contoh dari reaksi pembentukan gas ini ialah reaksi antara besi yakni dengan asam klorida yang membentuk besi(II) klorida serta jgua gas hidrogen. Persamaan dari reaksinya ialah sebagai berikut.
2Fe + 2HCl → FeCl2 + H2
-
Reaksi Hidrolisis
Reaksi Hidrolisis ini merupakan suatu reaksi kimia yang mana H2O (yakni molekul dari air) itu kemudian akan diurai/dipecah ke dalam sebuah bentuk kation H+ (hidrogen) serta juga bentuk anion OH–(hidroksida) dengan melalui proses kimiawi. Secara umum, bentuk reaksi hidrolisis ini diantaranya sebagai berikut.
X–(aq) + H2O(l) <-> HX(aq) + OH– (aq)
Ciri Reaksi Kimia
Contoh lain dari adanya perubahan atau reaksi kimia, selain dari batang korek api yang dibakar ini ialah sebuah besi yang korosif (atau berkarat). Adakah dari kamu yang kemudian bisa mengamati secara langsung mengenai bagaimana proses terbentuknya karat pada besi? Tentu pada saat terjadi sebuah reaksi kimia, kita kemudian tidak bisa/dapat melihat proses terbentuknya suatu senyawa baru dengan secara kasat mata. Tetapi, di dalam proses ini terdapat gejala atau pun juga ciri-ciri reaksi kimia yang telah atau sudah terjadi. Berikut ini merupakan beberapa ciri terjadinya reaksi kimia.
-
Terjadinya Perubahan Warna
Beberapa senyawa kimia mempunyai kecenderungan untuk menyerap serta memancarkan warna. Kemampuan menyerap serta juga memancarkan warna ini juga sangat spesifik untuk beberapa zat. Sehingga pada saat terjadi perubahan (konversi) zat dari reaktan itu menjadi produk (senyawa baru) kemudian maka akan terjadi perubahan warna.
Mungkin saja dari 2 reaktan yang tidak berwarna tersebut kemudian akan menghasilkan suatu produk senyawa berwarna, atau pun dari reaktan yang berwarna kemudian membentuk suatu produk yang tidak berwarna. Kejadian tersebut memperlihatkan terjadinya perubahan kimia atau pun reaksi kimia.
-
Perubahan Temperatur
Tiap-tiap senyawa kimia itu mempunyai energi dalam. Energi dalam ini adalah sebuah energi ikatan kimia dalam sebuah senyawa. Pemutusan ikatan tersebut memerlukan energi, sedangkan untuk pembentukan ikatan kimia itu melepaskan energi. Pada saat reaksi kimia yang terjadi itu melibatakan lebih banyak pembentukan ikatan kimia daripada pemutusan ikatan kimia, maka energi tersebut kemudian akan berlebih serta dilepaskan yakni sebagai panas serta temperatur naik.
Akan tetapi, apabila reaksi kimia itu melibatkan lebih banyak pemutusan ikatan apabila dibandingkan pembentukan ikatan, maka energi tersebut kemudian akan kurang serta diserap dari lingkungan menyebabkan dingin serta juga penurunan temperatur atau suhu.
-
Terbentuknya gelembung gas
Gas yang diproduksi di dalam reaksi kimia tersebut kemudianterkadang menyebabkan terjadinya atau terbentuknya suatu gelembung. Gelembung tersebut dapat atau bisa muncul dari pemanasan suatu cairan atau pun juga pembentukan gas di dalam cairan. Kedua kejadian tersebut adalah reaksi kimia yang umum terjadi.
-
Terjadi Perubahan Volume
Pada saat suatu senyawa baru terbentuk, maka senyawa reaktan tersebut kemudian akan berkurang dengan secara drastis. Pembentukan senyawa baru serta juga pengurangan reaktan tersebut bisa atau dapat menyebabkan terjadinya perubahan densitas (kerapatan) yang drastis sehingga kemudian volume berubah.
-
Terbentuknya Endapan
Pada saat mencampurkan dua zat yang larut di dalam pelarut, kemudian terbentuk padatan di bagian bawah larutan, hal ini menunjukan terjadinya reaksi kimia di dalam larutan tersebut. Pembentukan endapan tersenit terkadang berupa seperti partikel mikro (sangat kecil) yang melayang-layang di dalam larutan sehingga akan membuatnya tidak kasat mata. Untuk memastikannya dan melihatnya, kalian bisa atau dapat meyenterkan cahaya pada larutan tersebut. Fenomena tersebut kkemudian dikenal dengan istilah Efek Brown atau juga Brown Effect.
-
Pemancaran Cahaya
Reaksi kimia ini terkadang melepaskan energi di dalam bentuk cahaya. Contoh dari reaksi kimia ini ialah pada kunang-kunang serta juga jamur kelapa yang memancarkan cahaya pada saat malam.
-
Perubahan Konduktivitas
Beberapa reaksi kimia itu bisa atau dapat menghasilkan atau juga mengubah senyawa ion itu menjadi senyawa lain. Hal tersebut kemudian akan berpengaruh kepada perubahan konduktivitas (kemampuan di dalam menghantarkan panas) dari suatu sistem.
-
Terjadi Perubahan Bau
Beberapa senyawa kimia itu ialah seperti amoniak mempunyai bau yang menyengat. Maka pembentukan amoniak atau pun juga senyawa berbau lainnya itu kemudian akan menyebabkan terjadinya perubahan bau pada sistem.
-
Terjadi Perubahan Rasa
Senyawa kimia yang mempunyai rasa tertentu kemudian akan mengakibatkan perubahan rasa pada saat bereaksi. Ini dapat atau bisa dengan mudah diamati pada saat kita merebus ubi, awalnya rasa ubi itu tidak terlalu manis, kemudian setelah direbus kemudian akan terbentuk glukosa yang memiliki atau mempunyai rasa manis. Contoh lain ialah pada saat kita mengunyah nasi, pada awalnya nasi itu tidak berasa manis. Namun apabila kita kunyah secara terus menerus, maka nasi tersebut kemudian akan terasa sedikit manis.
-
Terjadi perubahan Titik Didih serta Titik Beku
Umumnya hal ini kemudian terjadi disebuah kristal. Untuk dapat mengetahui sebuah kristal tersebut sudah atau telah bereaksi atau belum, bisa atau dapat memakai titik didih serta juga titik bekunya.
Tahapan dan Faktor Laju Reaksi Kimia
Dengan Berdasarkan laju reaksinya, maka reaksi kimia ada yang kemudian berlangsung cepat, serta ada juga yang kemudian berlangsung lambat.
Contoh dari reaksi kimia yang kemudian berlangsung cepat ialah reaksi kimia dotablet effervescent pada waktu dilarutkan di dalam air, serta juga pada waktu menyalakan sebuah kembang api. dan untuk contoh dari reaksi kimia yang berlangsung lambat itu ialah pada proses korosi atau pada berkaratnya besi, kemudian juga pada reaksi pembuatan tempe serta tape.
Laju reaksi kimia tersebut bisa atau dapat ditentukan dengan cara mengukur berkurangnya jumlah reaktan yang bereaksi atau pun juga pertambahan jumlah produk yang terbentuk dari tiap satuan waktu tertentu. Laju dari reaksi kimia ini kemudian dipengaruhi oleh faktor-faktor lain, antara lain sebagai
berikut:
1. Pengaruh Ukuran Zat terhadap Laju Reaksi
Pada saat kamu melarutkan satu bongkah garam serta juga satu sendok garam halus itu ke dalam sebuah segelas air, maka garam halus itu akan lebih cepat larut apabila dibandingkan dengan garam bongkahan. Hal tersebut disebabkan karna ukuran butiran garam halus tersebut lebih kecil dibandingkan dengan ukuran bongkahan garam.
2. Pengaruh Suhu terhadap Laju Reaksi
Pemberian kalor atau pun juga pemanasan disuatu reaksi kimia itu memengaruhi laju reaksi. Pada reaksi eksoterm apabila suhu tinggi reaksi tersebut menjadi lambat, sedangkan pada reaksi endoterm, apabila suhu tinggi reaksi itu menjadi cepat.
Di dalam reaksi endoterm, disuhu tinggi, partikel-partikel zat tersebut kemudian akan bergerak lebih cepat daripada suhu rendah. Hal tersebutlah yang kemudian menyebabkan reaksi kimia tersebut berjalan lebih cepat. Reaksi kimia terjadi pada saat molekul-molekul serta juga atom-atom bertumbukan.
Menaikkan suhu tersebut berarti menaikkan energi kinetik partikel, sehingga partikel itu kemudian bergerak lebih cepat serta juga lebih sering bertumbukan. Inilah sebabnya kenapa laju reaksi di reaksi endoterm tersebut lebih cepat disuhu yang tinggi.
3. Katalis
Beberapa dari reaksi berlangsung tersebut dengan secara lambat walaupun suhu tinggi serta juga kontak antara zat yang bereaksi itu intensif. Di dalam hal ini, zat lain yang tidak terlibat di dalam reaksi tersebut bisa atau dapat mempercepat perubahan kimia. Zat lain ini kemudian disebut katalis. Katalis umumnya zat padat, namun bisa atau dapat juga berupa zat cair atau juga gas. Katalis tersebut mengubah laju reaksi, namun tidak memengaruhi dari hasil reaksi.
Hal tersebut kemudian dapat dituliskan:
A + B + Z ^ AB + Z
Jika zat A tersebut direaksikan dengan zat B dengan katalis Z, maka pada akhir reaksi tersebut diperoleh produk reaksi AB serta katalis Z.
Berbagai katalis ini dipergunakan di dalam mengubah laju dari bermacam-macam reaksi. Sel-sel hidup itu memiliki katalis reaksi yang disebut dengan istilah enzim yang memungkinkan terjadinya suatu reaksi kimia di dalam sel.
Enzim tersebut hanya dapat atau bisa bekerja dengan baik pada situasi atau keadaan tertentu misalnya seperti suhu serta juga pada tingkat keasaman tertentu. Contoh nya ialah enzim amilase yang berada dalam air ludah yakni sebagai katalis dari pereaksi pati yang kemudian menghasilkan produk reaksi maltosa.
Contoh Reaksi Kimia
Reaksi Kimia ini bisa terjadi di manapun juga. yang artinya contoh dari reaksi kimia ini sangat sering kita jumpai, dibawah ini merupakan beberapa contoh dari reaksi kimia :
-
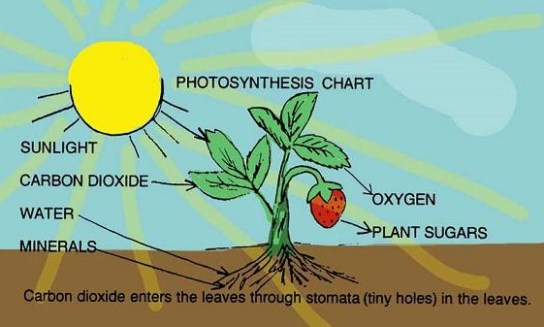
Fotosintesis
Fotosintesis ini merupakan proses yang dipakai oleh tanaman dan organisme lain untuk kemudian mengubah energi cahaya, biasanya dari Matahari, itu menjadi energi kimia yang bisa atau dapat kemudian dibebaskan untuk bahan bakar aktivitas organisme. Secara singkat, tanaman itu menggunakan reaksi kimia yang disebut dengan fotosintesis untuk mengubah karbon dioksida dan juga air menjadi makanan (glukosa) serta juga oksigen. Ini merupakan salah satu reaksi kimia yang bisa atau dapat ditemukan paling umum. Persamaan reaksi kimianya :
6 CO2 + 6 H2O + light → C6H12O6 + 6 O2
-
Respirasi Seluler Aerobik
Respirasi seluler aerobik ini ialah suatu proses yang merupakan kebalikan dari fotosintesis di dalam energi molekul digabungkan yakni dengan suatu oksigen yang kita hirup untuk kemudian melepaskan suatu energi yang dibutuhkan oleh sel kita ditambah karbon dioksida serta juga air. Energi yang digunakan atau dipakai oleh sel ialah energi kimia dalam bentuk ATP (adenosin trifosfat). Dibawah ini merupakan persamaan keseluruhan untuk respirasi sel aerobik:
C6H12O6 + 6O2 → 6CO2 + 6H2O + energy (36 ATPs)
-
Respirasi Anaerobik
Berbeda dengan respirasi aerobik, respirasi anaerobik ini kemudian menggambarkan satu set reaksi kimia yang memungkinkan sel untuk bisa mendapatkan energi itu dari molekul kompleks tanpa oksigen. Otot sel tersebut melakukan respirasi anaerob tiap kali kita membuang suatu oksigen yang setelah itu sampai kepada mereka, seperti pada saat latihan intens atau juga berkepanjangan. Respirasi anaerobik oleh ragi serta juga bakteri yang dimanfaatkan untuk fermentasi, atau pun juga untuk menghasilkan etanol, karbon dioksida, serta juga bahan kimia lain untuk membuat anggur, bir, keju, roti, yoghurt, serta juga banyak produk umum lainnya. Persamaan dari kimia secara keseluruhan untuk 1 bentuk respirasi anaerobik ialah :
C6H12O6 → 2C2H5OH + 2CO2 + energy
-
Logam Berkarat
Seperti yang sudah atau telah dikatakan diawal bahwa pengkaratan logam tersebut adalah salah satu dari contoh reaksi kimia yang dengan secara spesifik reaksi tersebut bisa atau dapat disebut dengan istilah reaksi oksidasi.dibawah ini merupakan persamaan reaksi besi berkarat:
Fe + O2 + H2O → Fe2O3.H2O
Demikianlah penjelasan mengenai Pengertian Reaksi Kimia, Persamaan, Ciri, Jenis, Faktor dan Contoh, semoga apa yang diuraikan dapat bermanfaat untuk anda. Terima kasih
[irp]
[irp]
[irp]